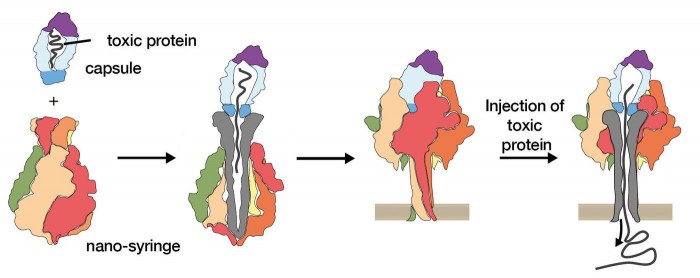
科学家尝试“劫持”细菌的微型“注射器” 将毒素换成有益的药物
许多细菌通过这种“注射器”机制感染宿主细胞,包括大肠杆菌和耶尔森氏菌等。这些细菌“锁”在细胞上,然后将通道推过其保护膜。细菌从那里将有毒蛋白质传递到细胞的脆弱中心,通常会在几分钟内杀死它。
马克斯·普朗克的研究人员此前曾使用低温电子显微镜研究了这一过程。这涉及将样品冷却至低温,然后通过强大的电子显微镜对其进行检查。这样一来,科学家就可以从三个维度和高分辨率观察这些蛋白质的结构。
对于这项新研究,研究小组分析了他们是否可以将这些有毒蛋白质有效载荷换成更有益的物质。可以肯定的是,只要满足三个条件,他们就可以。首先,该蛋白质必须具有一定的大小-其必须大于20kDa以保持稳定。其次,它们必须带正电荷。第三,它们不能与形成容纳有效载荷的“胶囊”的分子相互作用。
这项研究的首席研究员Stefan Raunser表示:“通过这项技术,我们朝着最终目标迈出了第一步,即使用这些纳米‘注射器’将药物有针对性地引入人体细胞。”
尽管该过程可以适应于向细胞传递良好的药物,但在某些情况下,也可以方便地注入有毒蛋白质。研究小组表示,可以设计出纳米“注射器”来“嗅出”癌细胞,锁住并向其输送毒物,而不会损害健康细胞。但是,为了使它发挥作用,需要做更多的研究来确定分子如何与细胞表面连接。
“我们目前正在寻找毒素的‘停靠站’,” Raunser表示。“一旦我们找到了它们并了解了毒素如何与细胞表面结合,我们的目标是特异性改变注射机制,使其能够识别癌细胞。然后我们可以将杀伤蛋白专门注入肿瘤细胞。这将为癌症药物带来最小副作用的全新可能性。”
这项研究发表在《自然通讯》杂志上。
相关标签
相关文章
王慧文病休53天,旗下OneFlow团队重新创业
1年以前 | 1次阅读
智己CEO现场怒怼!不满LS6和小鹏G6当对手
1年以前 | 1次阅读
董明珠回应落榜世界500强:总比爆雷的世界500强好
1年以前 | 1次阅读
阿里云上线 AI 视频生成工具 Live Portait:可一键让照片开口说话
1年以前 | 78次阅读
妙鸭相机将并入神力视界,阿里大文娱CTO郑勇:不是“搬家”是“回家”
1年以前 | 85次阅读
特斯拉上海超级工厂约40秒下线一台车,零部件本土化率超95%
1年以前 | 69次阅读
宁德时代发布神行超充电池,可实现充电10分钟行驶800里
1年以前 | 71次阅读
中科院博士被骗到缅甸已一年!女友:他负债几万,家里条件一般,以为去当翻译
1年以前 | 85次阅读
小鹏汽车否认收购玛莎拉蒂传闻:系谣言
1年以前 | 63次阅读
联想二季度净利润猛降66%,股价应声跳水
1年以前 | 80次阅读
业内人士:视觉中国对不同侵权主体采用差异化策略,老客由销售沟通新客发律师函
1年以前 | 70次阅读
恒大集团在美国申请破产保护
1年以前 | 56次阅读
劳斯莱斯首款纯电轿跑将在北美亮相
1年以前 | 89次阅读
realme印度前CEO确认加盟荣耀,即将推出手机新品
1年以前 | 88次阅读
OpenAI正在测试内容审核系统,一天可以完成六个月的工作
1年以前 | 80次阅读
谷歌百人“复仇者联盟”出击,将发对标GPT-4的大模型,26位研发主管名单流出
1年以前 | 77次阅读
OpenAI收购数字产品公司Global Illumination,为创立以来首笔公开收购
1年以前 | 80次阅读
海口规定:电动汽车充电服务费不得超过0.65元每度
1年以前 | 80次阅读
波音任命柳青为波音中国总裁
1年以前 | 88次阅读
业内人士谈图片复杂代理链:图片代理商越多摄影师分成越少
1年以前 | 67次阅读